O que são Ligações Químicas e como esse tema é abordado nos vestibulares
*Por Philippe Spitaleri, professor de química do Anglo Vestibulares

A maior parte dos átomos na natureza encontram-se ligados a outros átomos, por meio das denominadas ligações químicas. Essas interações, de natureza elétrica, são responsáveis pela manutenção da coesão das diversas estruturas que encontramos em nosso dia a dia e apresentam algumas particularidades, as quais são frequentemente exploradas nos principais vestibulares.
Veja a seguir uma questão da prova da FUVEST (2020) que apresentou essa temática:

Essa questão trabalha, de uma maneira conceitual, as possibilidades de combinações entre os átomos, originando diferentes tipos de compostos.
Os átomos de sódio (Na) e césio (Cs), mencionados no texto, correspondem a elementos metálicos pertencentes à família dos metais alcalinos, assim, poderiam se conectar por meio do estabelecimento de uma ligação metálica.
A ligação metálica ocorre entre átomos de metais através da formação de uma rede de elétrons deslocalizados, também denominada de mar de elétrons. Esses elétrons, relativamente livres, apresentam certa mobilidade e são responsáveis pelas propriedades que geralmente observamos nos metais, como a boa condutividade térmica e elétrica.
A seguir, temos uma representação da ligação metálica. Observe a presença dos cátions metálicos envolvidos pelo mar de elétrons:

Fonte: https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/ Supplemental_Modules_(Physical_and_Theoretical_Chemistry) /Chemical_Bonding/Fundamentals_of_Chemical_Bonding/Metallic_Bonding acesso em 18/02/2020
Em função do tipo de ligação entre metais, os compostos formados não podem ser denominados de moléculas.
As moléculas ou compostos moleculares são formados por meio de ligações do tipo covalente que ocorrem entre átomos de não-metais (ametais).
A ligação covalente é caracterizada pelo compartilhamento de elétrons entre os átomos e pode ser representada por meio de linhas de ligação. A seguir, temos a representação de uma molécula na qual os átomos estão conectados por meio de ligações do tipo covalente:

Fonte: https://www.researchgate.net/figure/Figura-1-Formula-estrutural-do-carbendazim_fig1_272908419 acesso em 19/02/2020
As propriedades dos compostos moleculares são bem distintas das propriedades dos compostos metálicos, em função dos tipos de átomos e da ligação formada entre eles.
Além dessas ligações descritas, existe um terceiro tipo que ocorre entre átomos de metais e ametais, denominada de ligação iônica. Esta ocorre por meio de uma transferência de elétrons entre metais e ametais, formando os compostos iônicos, distintos dos compostos metálicos e moleculares descritos anteriormente. Um exemplo característico de composto iônico é o cloreto de sódio (NaCl), principal componente do sal de cozinha.
Essas substâncias apresentam algumas propriedades bem definidas, como elevadas temperaturas de fusão e ebulição, encontrarem-se no estado sólido à temperatura ambiente e conduzirem corrente elétrica quando fundidas ou dissolvidas em água. Observe a seguir uma representação do retículo cristalino iônico do cloreto de sódio:
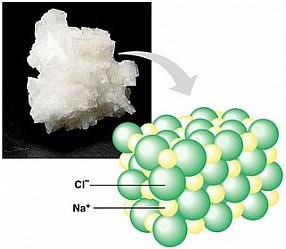
Fonte: https://mundoeducacao.bol.uol.com.br/quimica/caracteristicas-propriedades-dos-compostos-ionicos.htm acesso em 19/02/2020
Em relação aos principais exames vestibulares, são relativamente comuns questões que abordam os três tipos de ligações simultaneamente, exigindo que o aluno seja capaz de identificar os principais tipos de compostos formados a partir de cada uma. Veja um exemplo desse tipo de questão que apareceu na prova da FUVEST (2016):

Caso você tenha assinalado a alternativa (e) para a primeira questão apresentada e alternativa (a) para a segunda, muito bem, você gabaritou o assunto!
O estudo das ligações é de fundamental importância para uma boa realização da prova de química nos principais vestibulares do país, e o seu bom entendimento é um pré-requisito para a compreensão de tópicos mais avançados, como Termoquímica e Reações Orgânicas.
Desse modo, vale a pena dedicar algumas horinhas a mais a esse tema.
Bons estudos!


ID: {{comments.info.id}}
URL: {{comments.info.url}}
Ocorreu um erro ao carregar os comentários.
Por favor, tente novamente mais tarde.
{{comments.total}} Comentário
{{comments.total}} Comentários
Seja o primeiro a comentar
Essa discussão está encerrada
Não é possivel enviar novos comentários.
Essa área é exclusiva para você, assinante, ler e comentar.
Só assinantes do UOL podem comentar
Ainda não é assinante? Assine já.
Se você já é assinante do UOL, faça seu login.
O autor da mensagem, e não o UOL, é o responsável pelo comentário. Reserve um tempo para ler as Regras de Uso para comentários.