Você conhece o fenômeno da alotropia?
*por Philippe Spitaleri Kaufmann, professor e autor do Anglo Vestibulares e do Colégio Anglo São Paulo
A alotropia é um fenômeno no qual um mesmo elemento químico apresenta a possibilidade de formar substâncias simples diferentes. Essas substâncias podem divergir entre si em relação à atomicidade (número de átomos) ou quanto ao arranjo geométrico das estruturas.
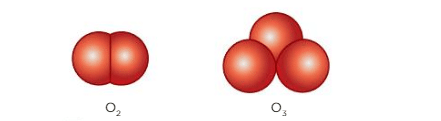
Um exemplo simples desse fenômeno consiste na alotropia do elemento oxigênio, que pode dar origem às substâncias simples gás oxigênio (O2) e gás ozônio (O3). Essas substâncias divergem tanto na atomicidade como na geometria molecular, como representado pela imagem abaixo:
Um outro caso importante, que tem sido destaque na mídia recentemente, refere-se aos principais alótropos do carbono: diamante, grafite, grafeno e fulereno.
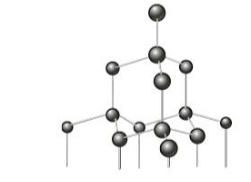
O diamante é um material extremamente duro e resistente formado exclusivamente por átomos de carbono dispostos em uma rede cristalina tetraédrica.
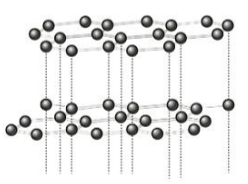
Já o grafite consiste de um material macio, facilmente deformável, condutor de corrente elétrica e que pode ser utilizado como lubrificante. As propriedades do grafite são derivadas principalmente de sua organização submicroscópica, na qual os átomos de carbono encontram-se dispostos em folhas de redes hexagonais, sobrepostas entre si.
O grafeno consiste de uma monocamada de grafite que quando enrolada sobre o seu próprio eixo pode formar os famosos nanotubos de carbono.
Por se tratar de uma única folha, apresenta a espessura de um átomo. Essa variedade alotrópica do carbono possui características específicas como elevada resistência e flexibilidade, condutibilidade elétrica e térmica, além de ser muito leve.
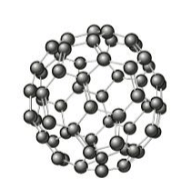
Por fim, o fulereno consiste de uma espécie de "gaiola" formada exclusivamente por átomos de carbono.
Essa substância tem sido utilizada na confecção de placas fotovoltaicas e há também o desenvolvimento de pesquisas na área médica para a utilização do fulereno como um "carregador" de medicamentos no interior do organismo humano.
Embora os alótropos do oxigênio e do carbono sejam os principais casos que podem ser explorados nos exames vestibulares, podemos citar ainda a alotropia do enxofre e do fósforo.
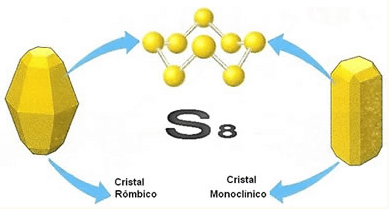
O enxofre forma basicamente duas formas alotrópicas que divergem entre si em relação ao arranjo cristalino de suas estruturas, o enxofre rômbico e o monoclínico. Essas duas variedades são formadas por moléculas com oito átomos que podem ser representadas pela fórmula S8 .
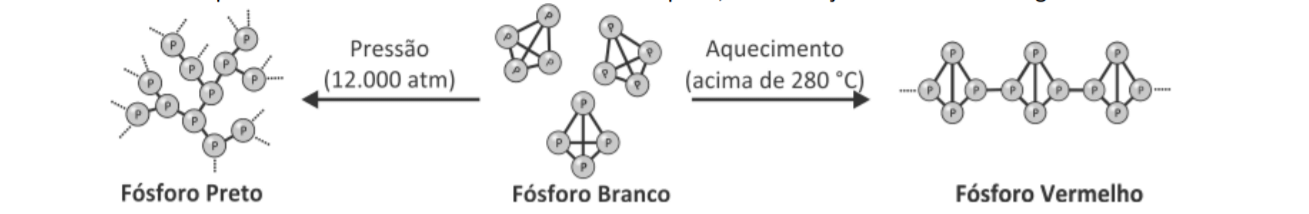
O fósforo, por sua vez, pode formar muitas variedades alotrópicas, entre as quais o fósforo vermelho e o fósforo branco são as mais comuns. A alotropia do fósforo foi explorada na prova de Química da segunda fase da Fuvest de 2018, da qual foi extraída a imagem a seguir:
Ainda, vale lembrar que, em 20 de dezembro de 2017, durante uma reunião plenária, a Assembleia Geral das Nações Unidas escolheu o ano de 2019 como o Ano Internacional da Tabela Periódica, em comemoração à sua proposição em 1869 pelo cientista russo Dmitri Mendeleev.
Segundo o próprio site oficial da Unesco:
O IYPT 2019 é uma oportunidade para se refletir sobre os muitos aspectos da Tabela Periódica, incluindo sua história, o papel das mulheres na pesquisa científica, as tendências e as perspectivas mundiais sobre a ciência para o desenvolvimento sustentável, além dos impactos sociais e econômicos dessa área.
Assim, é esperado que temas que estejam relacionados às propriedades dos elementos químicos, como a alotropia, sejam explorados e cobrados nos principais exames vestibulares.







ID: {{comments.info.id}}
URL: {{comments.info.url}}
Ocorreu um erro ao carregar os comentários.
Por favor, tente novamente mais tarde.
{{comments.total}} Comentário
{{comments.total}} Comentários
Seja o primeiro a comentar
Essa discussão está encerrada
Não é possivel enviar novos comentários.
Essa área é exclusiva para você, assinante, ler e comentar.
Só assinantes do UOL podem comentar
Ainda não é assinante? Assine já.
Se você já é assinante do UOL, faça seu login.
O autor da mensagem, e não o UOL, é o responsável pelo comentário. Reserve um tempo para ler as Regras de Uso para comentários.