2019: O Ano Internacional da Tabela Periódica
Em 20 de dezembro de 2016, a Organização das Nações Unidas (ONU), por meio da UNESCO e com o apoio da IUPAC, declarou 2019 o Ano Internacional da Tabela Periódica. O ano foi escolhido pois em 2019 fará 150 anos da proposição da tabela periódica e coincidirá com o aniversário de 100 anos da IUPAC (União Internacional de Química Pura e Aplicada).
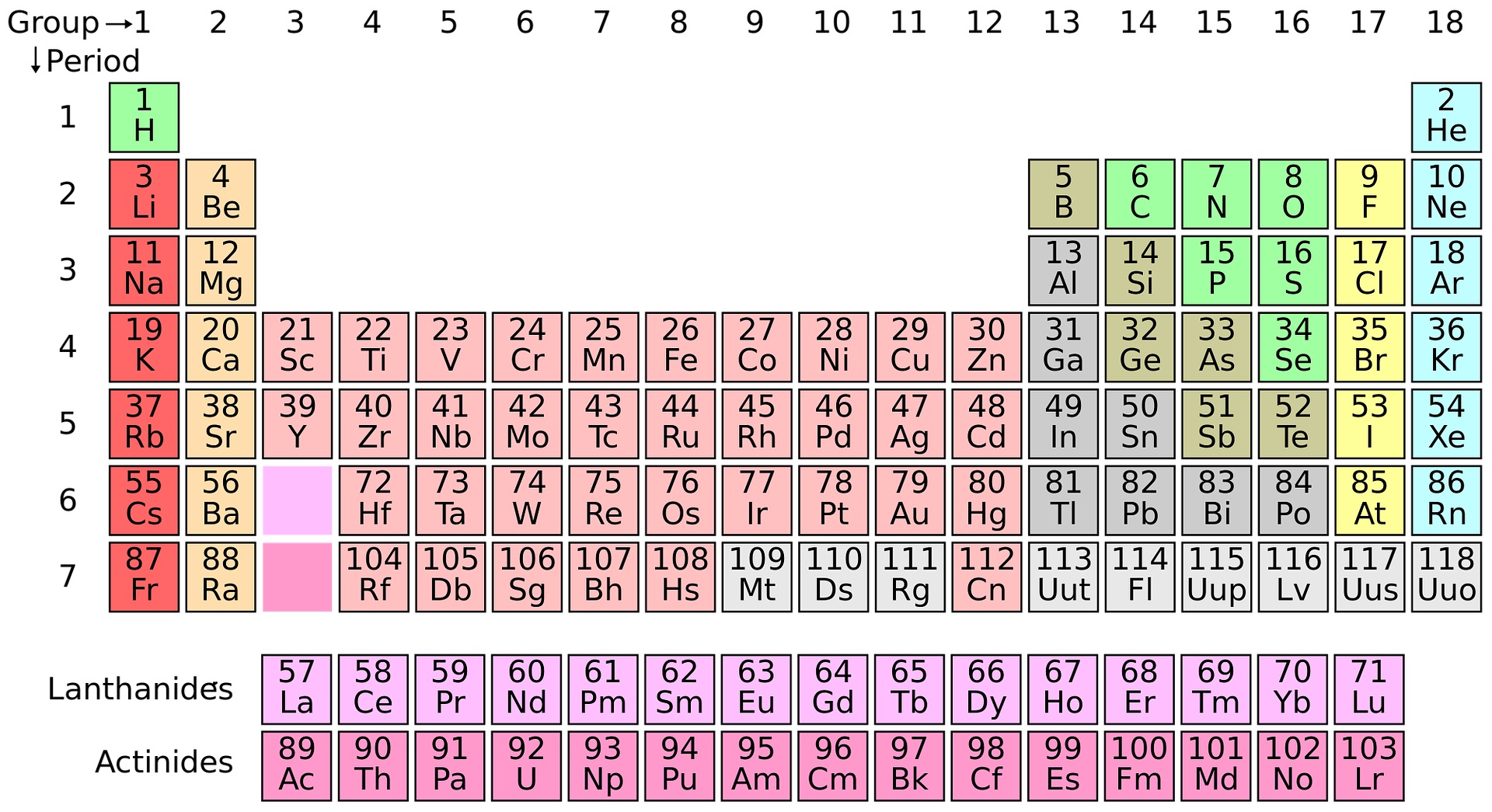
A tabela periódica como conhecemos hoje foi proposta em 1869 pelo russo Dmitri Mendeleev de forma a organizar os elementos químicos. Os que possuem propriedades semelhantes foram colocados numa mesma coluna, mas, durante a organização, Mendeleev percebeu que parecia faltar alguns elementos e resolveu deixar alguns espaços em branco. Hoje, todos esses espaços foram preenchidos.
É importante o vestibulando associar a estrutura do átomo com a tabela periódica e saber que os elementos não foram colocados nela de forma aleatória. É necessário conhecer como a tabela foi organizada: os elementos químicos estão listados por ordem crescente de seu número atômico (número de prótons no núcleo). O hidrogênio é o primeiro elemento, pois possui um próton no seu núcleo; o hélio é o segundo elemento, pois possui dois prótons no seu núcleo e assim por diante.
As linhas horizontais são denominadas períodos e indicam o número de camadas eletrônicas. As linhas verticais são chamadas de famílias ou grupos (elementos do mesmo grupo apresentam propriedades semelhantes). Para os elementos representativos (bloco A da tabela), o número da família representa o número de elétrons da camada de valência.
Outra divisão importante da tabela é a de metais, ametais e gases nobres. Os metais representam a maior parte dos elementos da tabela e possuem as seguintes propriedades: sólidos a 25°C (exceto o mercúrio, que é líquido) são bons condutores de calor e eletricidade, são dúcteis e maleáveis (propriedades de fazer fios e lâminas, respectivamente). Os ametais em geral são isolantes térmicos e elétricos e seu estado físico varia; os gases nobres são gasosos a temperatura ambiente e inertes quimicamente.
No espaço reservado para cada elemento químico constam dois números: o número de prótons e o número de massa. O número de massa é a soma de prótons mais nêutrons, logo o maior valor apresentado refere-se ao número de massa. Esse valor é importante para exercícios que envolvem transformação de massa em mol e vice-versa, como exercícios de estequiometria, soluções e mol.
O vestibulando precisa conhecer a prova que irá prestar. Por exemplo, nas provas realizadas pela Vunesp (Unesp, Santa Casa, Albert Einstein, Santa Marcelina, etc) e Enem, a tabela periódica é fornecida e é importante o vestibulando criar o hábito de consultá-la ao fazer as tarefas. A Fuvest não fornece em sua prova a tabela, mas qualquer dado necessário é fornecido na forma de note e adote.
Os examinadores buscam em suas questões fazer contextualizações, e um assunto que tem grandes chances de aparecer nas próximas provas é tabela periódica. Por isso, ao iniciar os estudos de química, tenha sempre por perto uma tabela, pois, ao usá-la com frequência, você estará sempre lembrando sua organização e como tirar dela as informações necessárias.





ID: {{comments.info.id}}
URL: {{comments.info.url}}
Ocorreu um erro ao carregar os comentários.
Por favor, tente novamente mais tarde.
{{comments.total}} Comentário
{{comments.total}} Comentários
Seja o primeiro a comentar
Essa discussão está encerrada
Não é possivel enviar novos comentários.
Essa área é exclusiva para você, assinante, ler e comentar.
Só assinantes do UOL podem comentar
Ainda não é assinante? Assine já.
Se você já é assinante do UOL, faça seu login.
O autor da mensagem, e não o UOL, é o responsável pelo comentário. Reserve um tempo para ler as Regras de Uso para comentários.